肝纤维化(LF)是多种病因导致的慢性肝脏疾病,先天免疫和适应性免疫在其形成过程中发挥关键作用。大量研究已证实肝脏内CD8+T细胞具有促纤维化作用,NK细胞具有抗纤维化能力,但肝脏内B细胞的作用尚未明确。间充质干细胞(MSCs)因其具有免疫调节特性,被认为是一种很有前景的肝纤维化治疗方法。
近期,浙江大学医学院附属第一医院曹红翠教授团队在Hepatology发表了题为“Mesenchymal stem cells alleviate mouse liver fibrosis by inhibiting pathogenic function of intrahepatic B cells”的文章,他们发现MSC的注射显著改善了肝纤维化,表现为肌成纤维细胞活化、胶原沉积和炎症表型的减少,并将这一效果归因于肝内B细胞的浸润能力、活化表型和促炎细胞因子产生的减少。他们通过单细胞RNA测序建立了一个肝内B细胞图谱,并鉴定出一种在纤维化肝脏中显著增长的幼稚B细胞亚型(B-II),其显示出成熟活化特征,并具有多种增殖和炎症基因的高表达。在B细胞缺失的小鼠(μMT)或体内抗CD20治疗的小鼠中,纤维化得到减轻。此外,通过B细胞的被动转移,μMT小鼠中重新出现纤维化,但这种纤维化可以通过MSC注射来缓解,这验证了B细胞的致病功能以及MSC在B细胞促进肝纤维化中的疗效。文章还验证了MSC可以通过外泌体调控MAPK和NF-kappa B信号通路,以抑制肝内B细胞的增殖和细胞因子的产生。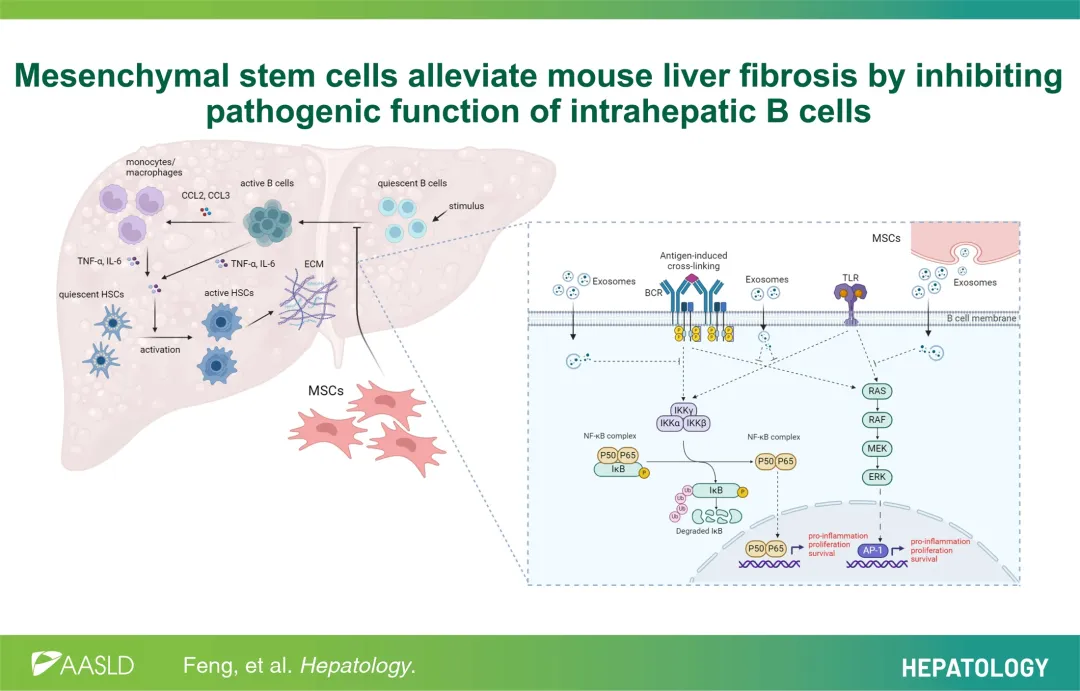
1.MSCs 缓解了 CCl4 诱导的肝纤维化
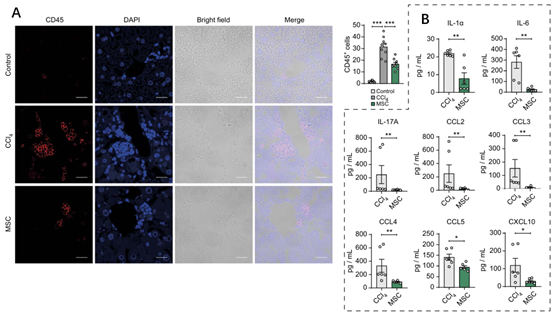
在C57BL/6小鼠中,通过反复腹腔注射CCl4(每周两次,持续8周)建立了肝纤维化(LF)模型。为了评估MSC对LF的影响,作者在纤维化诱导的同时给予MSC治疗(图二A)。MSC治疗显著降低了几种肝纤维化标志物和促纤维化因子的表达,包括I型和III型胶原、Tgfβ1和Ccl2(图二B)。MSC治疗的小鼠表现出减少的肝疤痕、较低的肌成纤维细胞活化(由α平滑肌肌动蛋白指示)和较少的胶原沉积(图二C、D)。在纤维化肝脏中,静脉血管周围的CD45+免疫细胞浸润在MSC治疗组中显著减弱(图三A)。MSC输注组血清中炎症细胞因子(如IL-1α、IL6和IL-17A)以及促炎趋化因子(如CCL2、CCL3、CCL4、CCL5和C-X-C基序趋化因子配体10)水平显著降低(图三B)。这些结果表明,MSC通过抑制肌成纤维细胞活化、胶原沉积和炎症,延缓了CCl4诱导的肝纤维化进程。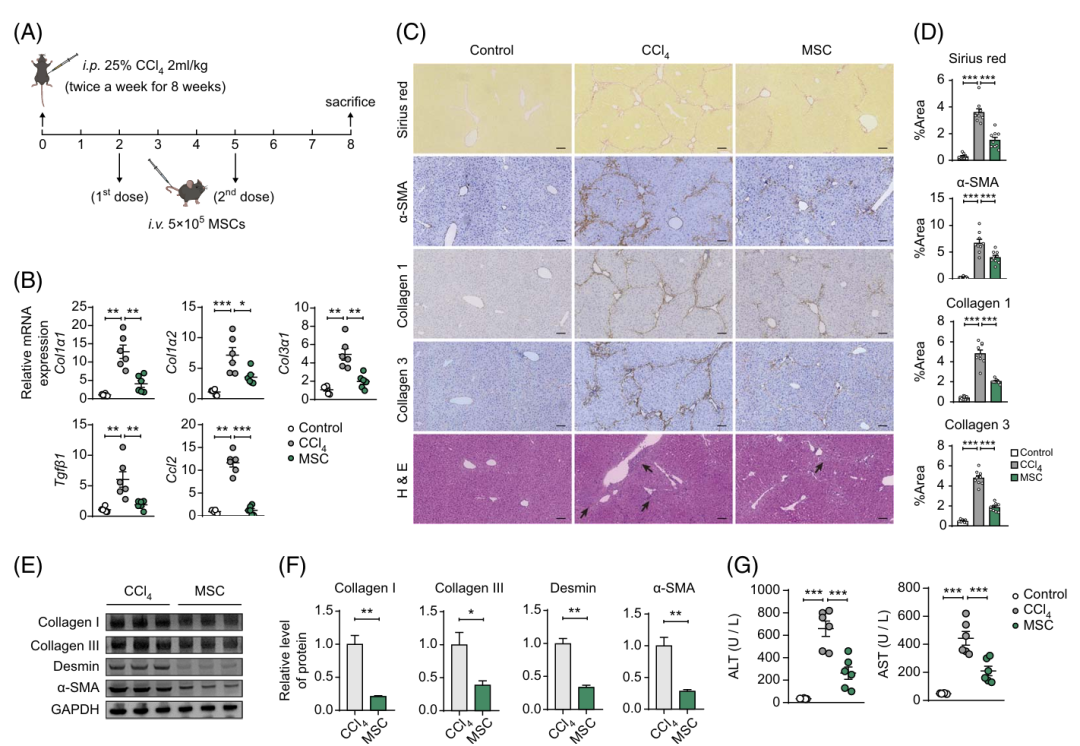
2.MSC治疗在肝纤维化进展过程中抑制了B细胞的浸润和表型激活
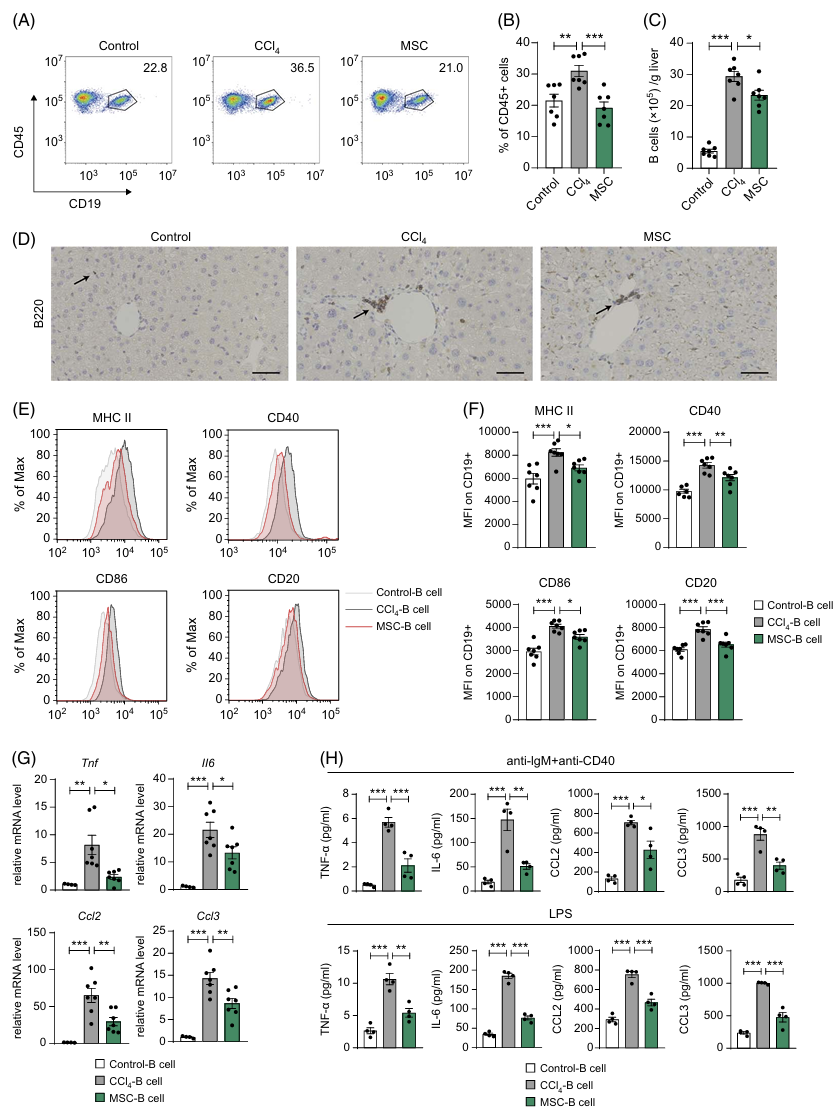
作者进一步分析了肝脏内浸润的B细胞特征。CCl4处理组与对照组比较显示,肝脏中B细胞的比例和数量显著增加,而接受MSCs治疗的小鼠肝脏内B细胞数量明显减少(见图四A-C)。免疫组化分析显示,正常肝组织中B细胞分布稀疏,而纤维化肝脏中B细胞显著增加,主要聚集在血管区域。MSCs治疗减少了这些B细胞聚集,表明了肝脏内B细胞浸润的减少(见图四D)。CCl4处理组中,肝脏内B细胞显示升高的激活状态和抗原呈递能力,如表面标记物(CD40、CD86、CD20)的表达增加。相反,MSCs处理组中肝脏内B细胞的激活状态似乎受到了抑制(见图四E, F)。评估B细胞中Tnf、Il6、Ccl2和Ccl3基因的表达水平差异显示,CCl4处理组中这些基因的表达水平明显升高。与此相反,MSCs处理组中这些基因的表达水平与CCl4处理组相比有所降低(见图四G)。CCl4处理组的B细胞产生更高水平的细胞因子,而这种促炎细胞因子产生在MSCs治疗后得到了减少(见图四H)。MSC治疗后,肝脏内B细胞的浸润和功能活性均受到了抑制。这些结果表明,在纤维化进程中,B细胞呈现出更活化的表型,积聚在肝脏中,释放促炎细胞因子并呈递抗原,而MSC输注能够有效地抑制这一现象。
3. 单细胞RNA测序建立了肝脏浸润性B细胞的图谱
为了深入了解CCl4诱导的LF和MSC治疗期间的肝内B细胞亚群情况,作者对来自健康、纤维化和接受MSC治疗的肝脏内B细胞进行了scRNA-seq分析(图五A),最终鉴定了具有明显转录标志的9个B细胞谱系聚类(图五B-D),并利用已知的B细胞标记基因为这9个亚组进行了注释。这些包括表达免疫球蛋白重链常数δ和免疫球蛋白M受体的Fc片段的原始B细胞(聚类1–7)、低表达Fcmr的未知B细胞(聚类8)和表达Igha和J链的浆细胞(聚类9)(图五E,F)。来自肝脏的B细胞中超过98%是原始B细胞。伪时间轨迹分析显示,沿着轨迹方向,对照组中B细胞的标志逐渐转化为CCl4组B细胞的标志,而MSC组B细胞的标志位于路径中段(图五G)。此外还观察到一部分原始B细胞(聚类2、4和7)在健康或MSC治疗的肝脏中特别稀少,但在纤维化肝脏中丰富(图五H,I),而另一部分原始B细胞(聚类1、3、5和6)表现出相反的趋势。结合每个聚类的表达谱的相关性,作者重新定义了聚类1、3、5和6为原始B-I,聚类2、4和7为原始B-II(图五F,J)。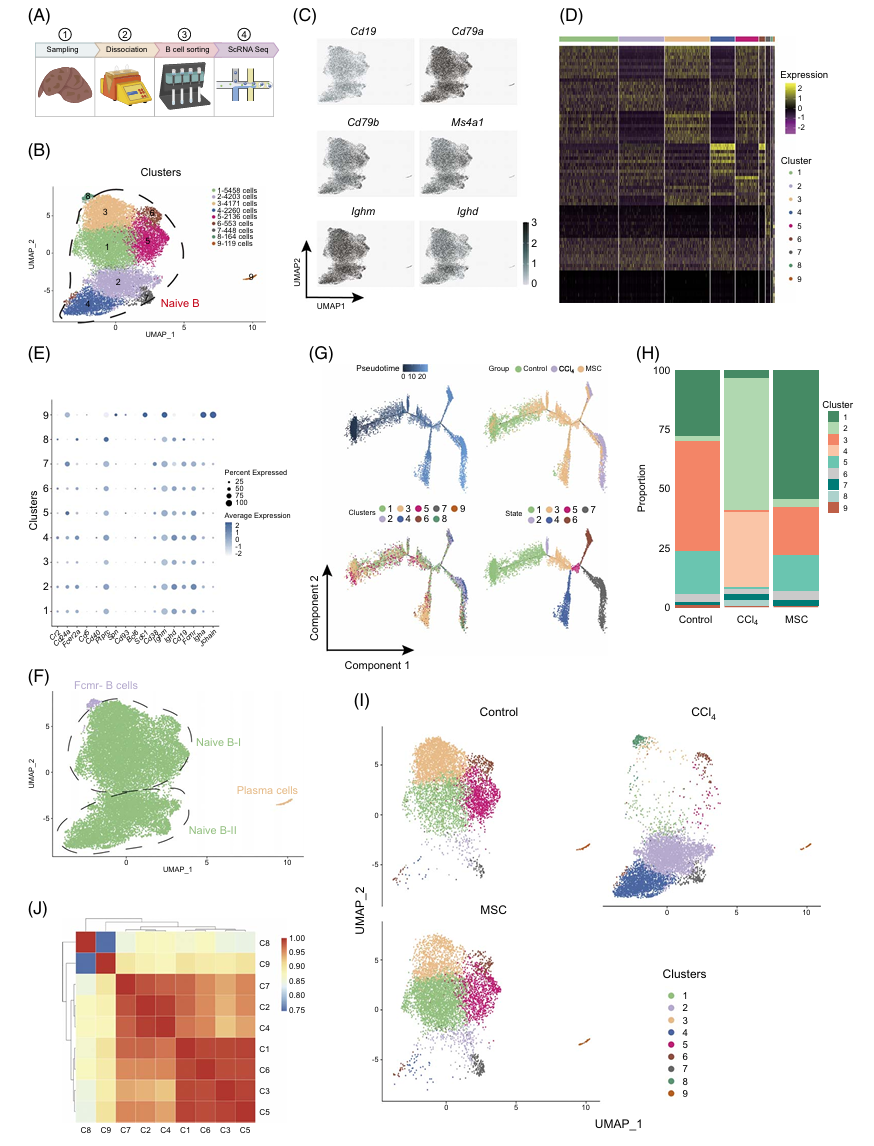
4.MSCs调节了纤维化过程中肝内B细胞的基因表达谱,影响其激活、增殖和促炎功能
作者分析了不同组别中B细胞的基因差异表达。正常和纤维化肝脏的B细胞之间有1557个差异表达基因(732个上调,825个下调)。纤维化肝脏的B细胞中增殖相关基因(Fos、Jun、Map2k1)及炎症相关基因(nfkb1、Cxcr4、Cxcr5、Ccr7、H2-Aa、Traf4、Tnfaip3)表达增加(图六A-C)。热图分析区分了纤维化肝脏和正常肝脏中的B细胞(图六D)。富集分析显示,上调基因在B细胞激活、受体信号通路、细胞周期及增殖调控等方面富集(图六E)。KEGG分析显示,上调的差异表达基因与B细胞受体信号通路、抗原处理和呈递、白细胞迁移等相关(图六F,G)。 进一步分析发现,MSC治疗的肝脏中B细胞的增殖基因Jun和炎症基因Cxcr4、H2-Aa、S100a8、S100a9、Traf4、Tnfrsf13c、Traf1下调(图六H)。MSC组中B细胞下调基因富集在细胞因子反应、细胞周期调控、炎症反应、趋化作用及B细胞受体信号通路(图六I)。KEGG分析显示,下调的差异表达基因与抗原处理和呈递、内质网蛋白加工、IL-17信号通路等相关(图六J)。GSEA显示,MSC组中B细胞激活、增殖、受体信号通路、MAPK信号通路、NF-kappa B信号通路及Toll样受体信号通路基因集受到抑制(图六K)。这些结果表明,肝内B细胞在LF过程中表现出激活、增殖及促炎基因特征,而MSC治疗可以抑制这些基因的表达。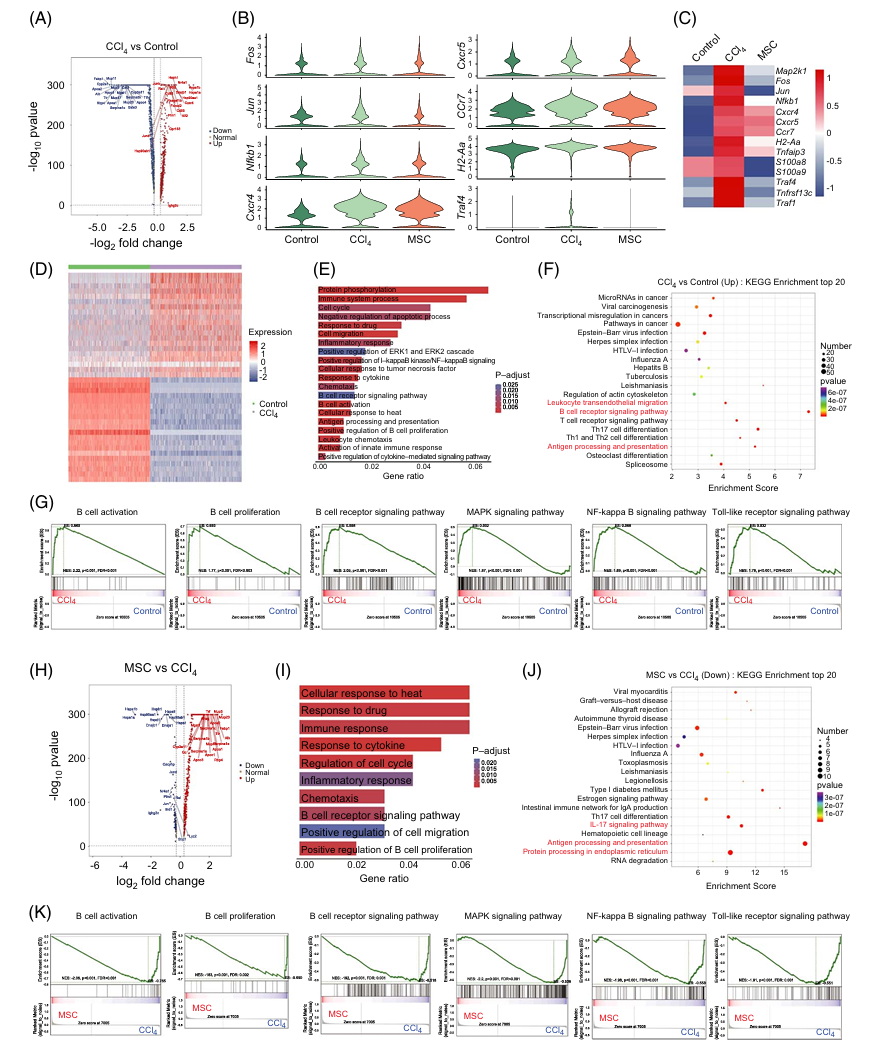
5.B细胞参与了肝纤维化的形成,并可作为MSC发挥治疗作用的靶细胞
以上证据表明,在肝纤维化过程中,B细胞表现出激活、增殖和促炎症等表型,但其与肝纤维化严重程度之间的直接因果关系尚不明确。为确定B细胞在肝纤维化中的作用,作者进一步研究了CCl4处理8周的μMT小鼠(缺乏成熟B细胞)的肝纤维化进展情况(图七A)。结果显示,μMT小鼠的纤维化病变较野生型小鼠明显减轻(图七B-D)。然而,在B细胞缺失的肝纤维化小鼠中移植MSC并未显示进一步疗效(图七B-D),这表明MSC疗效可能依赖于肝脏内B细胞。此外,将WT小鼠的B细胞转移至μMT小鼠,加重了肝损伤和纤维化,而MSC治疗可缓解这一效应(图七E-H)。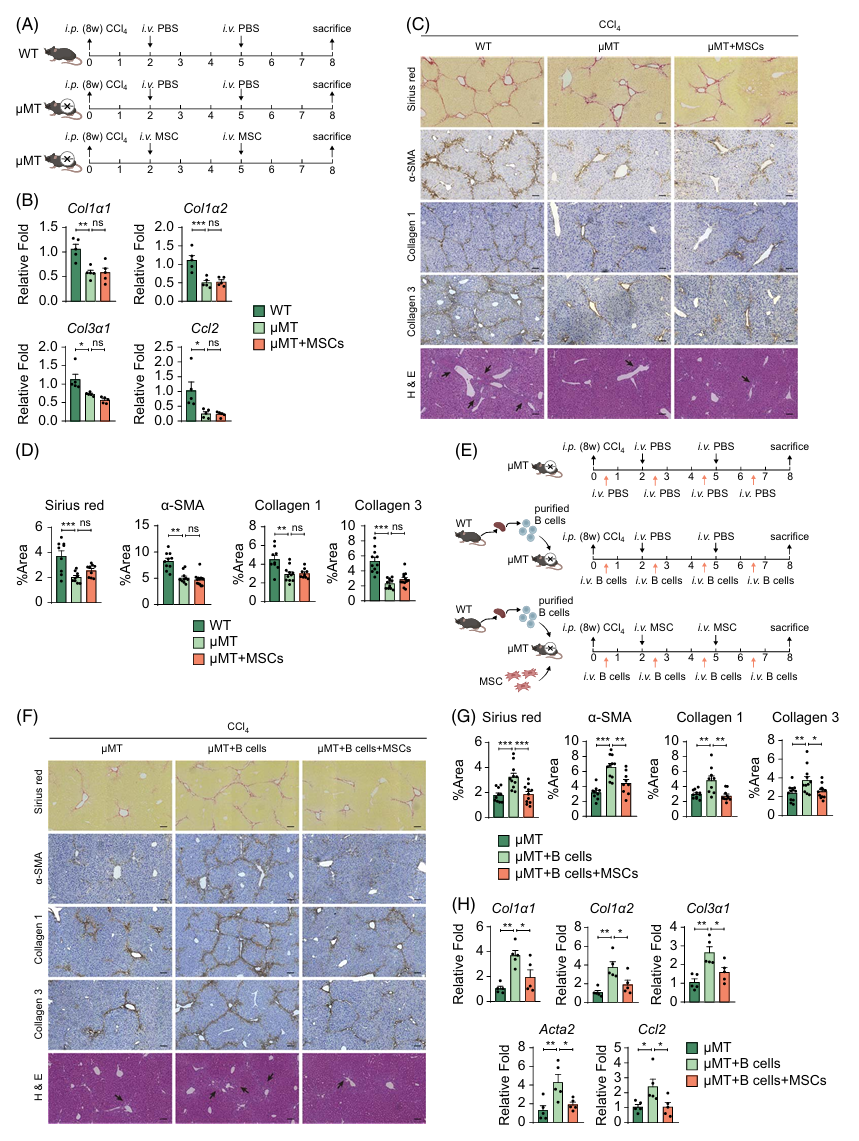
6.MSC来源的分泌物介导了对B细胞功能的影响
利用Transwell共培养系统,使MSCs和B细胞分离(不直接接触),MSCs对B细胞增殖的抑制作用依然存在(图八A, B)。MSC组中B细胞G0/G1期延长,S期和G2/M期缩短(图八C, D),细胞周期相关基因Ccnd2和Ccne1的mRNA水平降低(图八E),c-Myc、Cyclin D2和Cyclin E1的蛋白表达也减少(图八F)。这些结果表明,MSCs通过其分泌物调控B细胞的细胞周期分布和进程。此外,MSCs还抑制了刺激后B细胞的细胞因子产生功能,包括Tnf、Il6、Ccl2和Ccl3的mRNA水平(图八G)以及TNF-α和IL-6的分泌(图八H-J)。综上所述,MSCs通过其分泌物抑制肝内B细胞的功能
7.外泌体是MSC抑制肝内B细胞功能的关键效应机制
MSCs分泌物包括蛋白质可溶性部分(如生长因子和细胞因子)和囊泡部分(包括微囊泡和外泌体)。为验证MSCs对肝内B细胞抑制作用中是否涉及外泌体,作者抑制了MSCs的外泌体释放。经GW4869预处理的MSCs对B细胞增殖、细胞周期进展和促炎功能的抑制效果有限(图九A-D)。接着,作者提取了MSCs来源的外泌体(ExoMSC)来验证其对B细胞功能的影响。ExoMSC处理抑制了在αIgM/αCD40或脂多糖刺激条件下的B细胞增殖(图九E-H),这可能与其调控细胞周期有关,因为大多数B细胞停留在G0/G1期(图九I-K)。同时,ExoMSC组中部分促炎基因(Tnf、Il6、Ccl2和Ccl3)的表达水平较低(图九L, M)。在纤维化肝脏中分离的激活B细胞上清液中,ExoMSC处理组产生的促炎细胞因子水平较低(图九N, O)。
对于B细胞而言,MAPK和NF-kappa B信号传导对适当激活、增殖和促炎细胞因子的产生至关重要。如上述的测序结果所示,激活的B细胞中p-ERK、核因子kappa B抑制蛋白激酶α/β的磷酸化和核P65的信号显著增加,但在ExoMSC存在下,这些蛋白的表达减少(图十A-D)。为确切证明ExoMSC通过MAPK和NF-kappa B信号通路抑制B细胞功能,作者利用PMA激活这些信号通路,发现ExoMSC能逆转这种抑制,恢复B细胞的增殖和细胞因子产生的功能(图十F-I)。这表明ExoMSC可能主要靶向这两条信号通路中的上游分子。综上所述,外泌体是MSC抑制B细胞功能的关键因素,主要通过调控MAPK和NF-kappa B信号通路实现。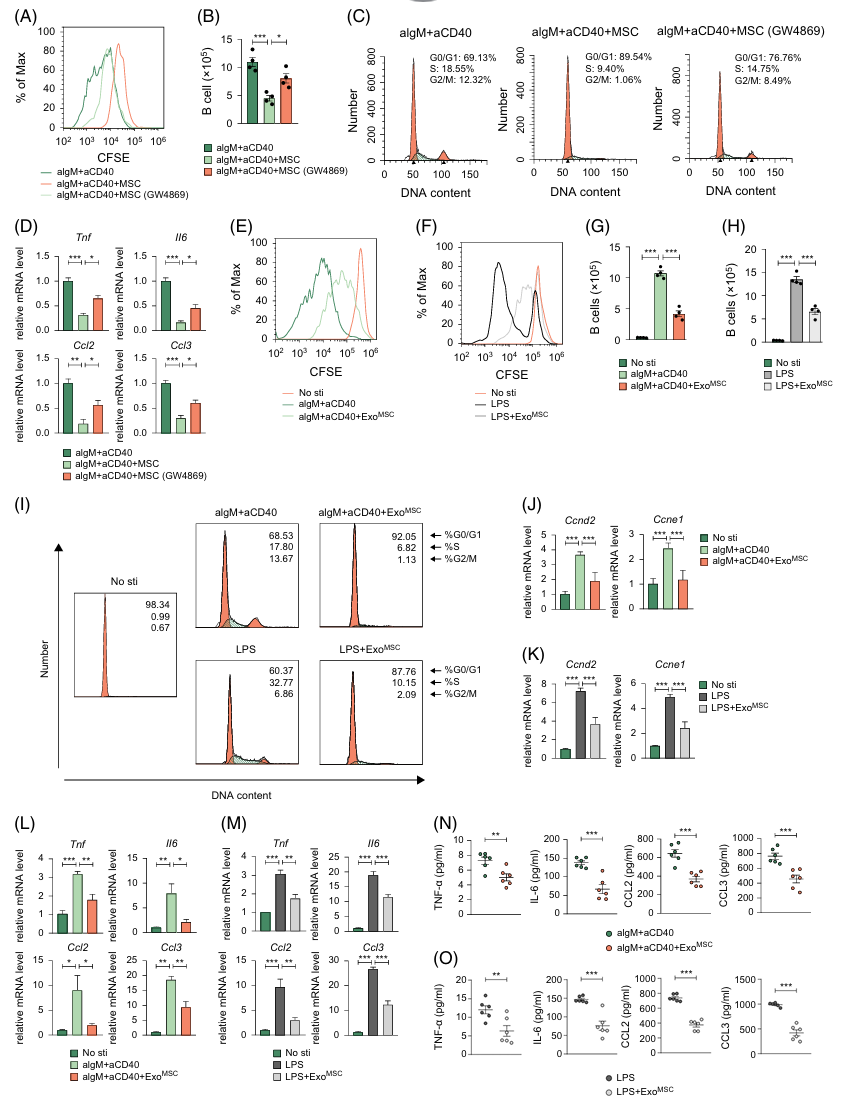
 研究结论
研究结论
综上所述,作者利用单细胞RNA测序详细描述了肝脏纤维化进展过程中B细胞的转录特征,并证明了MSCs通过外泌体抑制肝内B细胞功能来发挥治疗作用,同时还揭示了外泌体通过调节MAPK和NF-kappa B信号通路介导了这一抑制作用。本研究对揭示MSCs治疗纤维化的作用机制具有重要意义,并为利用MSC治疗肝脏纤维化提供了潜在靶点。
参考文献:
Feng X, Feng B, Zhou J, Yang J, Pan Q, Yu J, Shang D, Li L, Cao H. Mesenchymal stem cells alleviate mouse liver fibrosis by inhibiting pathogenic function of intrahepatic B cells. Hepatology. 2024 Mar 28.



