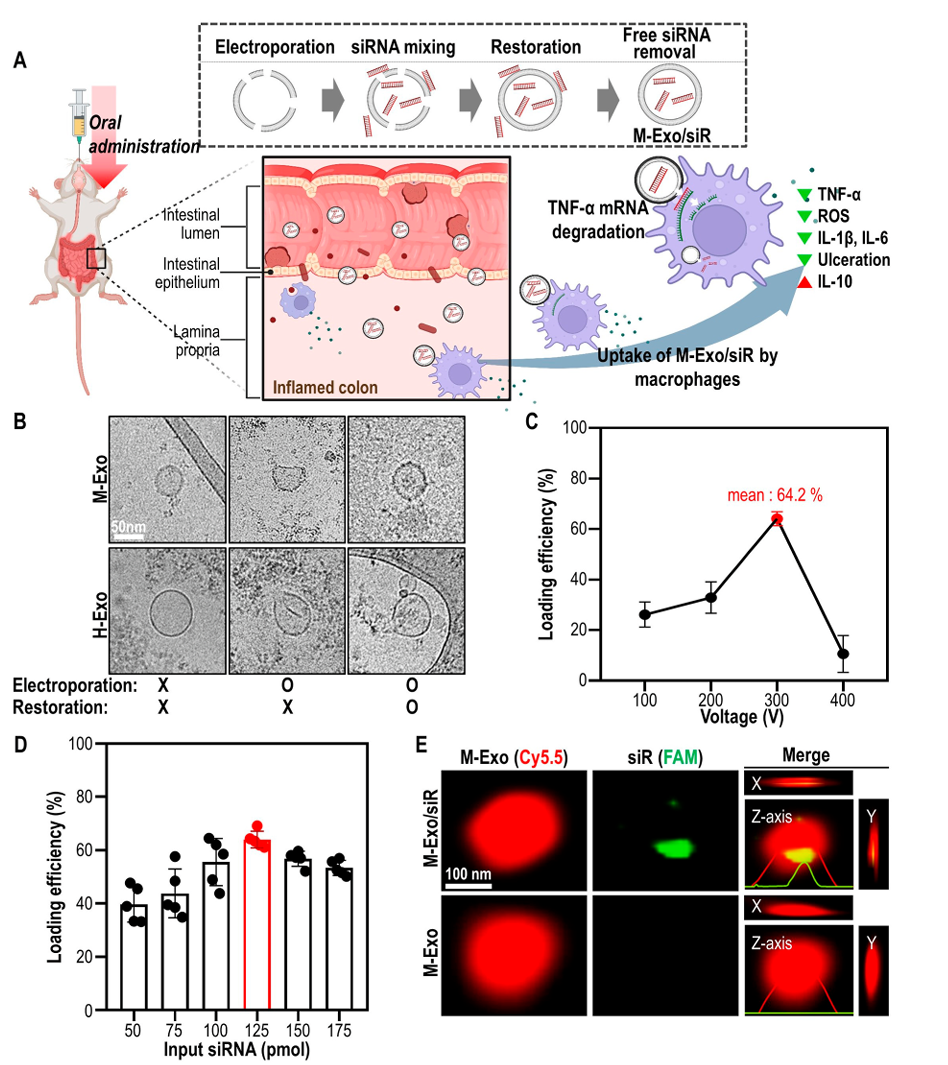
2.1 采用电穿孔技术将siRNA装载到M-Exos
作者改进了传统的电穿孔方法,在电穿孔后,继续在4℃下孵育3小时加以稳定M-Exo膜(图1A),并与另一种来源于HEK293T细胞培养基(H-Exo)的外泌体进行比较。通过冷冻透射电子显微镜(cryo-TEM)可见,电穿孔后,M-Exos和H-Exos立即出现结构变形和表面裂纹(图1B)。在4℃孵育3小时后,M-Exos恢复到球形,H-Exos表面仍粗糙。表明M-Exo可保护siRNA免受外部刺激的影响。
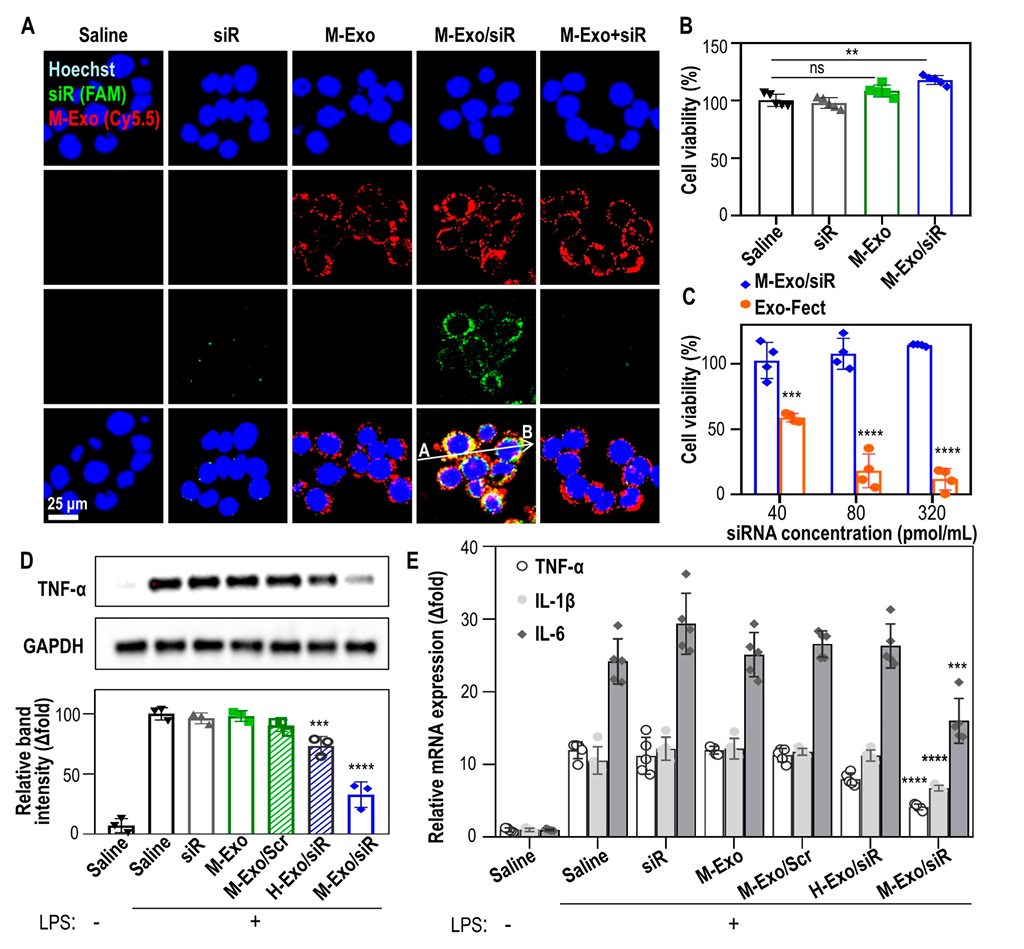
2.2 M-Exo/siR通过下调TNF-α水平改善炎症,而不诱导细胞毒性
首先,作者明确了NCM460细胞可进行siRNAs的摄取,在用荧光标记的M-Exo/siR处理NCM460细胞24小时后,测量M-Exos和siRNA荧光之间的相关性,相关系数为0.1923,表明大多数siRNA是从M-Exos释放的。M-Exos和siRNA的简单混合物(M-Exo+siR),因siRNA没有被包裹,所以不能将其递送到细胞质中(图2A)。图2B显示用siR、M-Exo或M-Exo/siR处理NCM460细胞不会诱导细胞毒性,即使siRNA的转染浓度高达320 pmol/mL,也没有观察到细胞毒性反应。
随后,作者进一步探究,M-Exo/siR递送siRNA是否真正降低了细胞中TNF-α的mRNA和蛋白水平。图2D中可以观察到,在M-Exo/siR处理后,LPS介导的TNF-α表达量显著降低67.2%。图2E展示了相关促炎细胞因子的表达,与对照组相比,M-Exo/siR治疗组的IL 1β、IL 6和TNFα的表达被显著抑制。
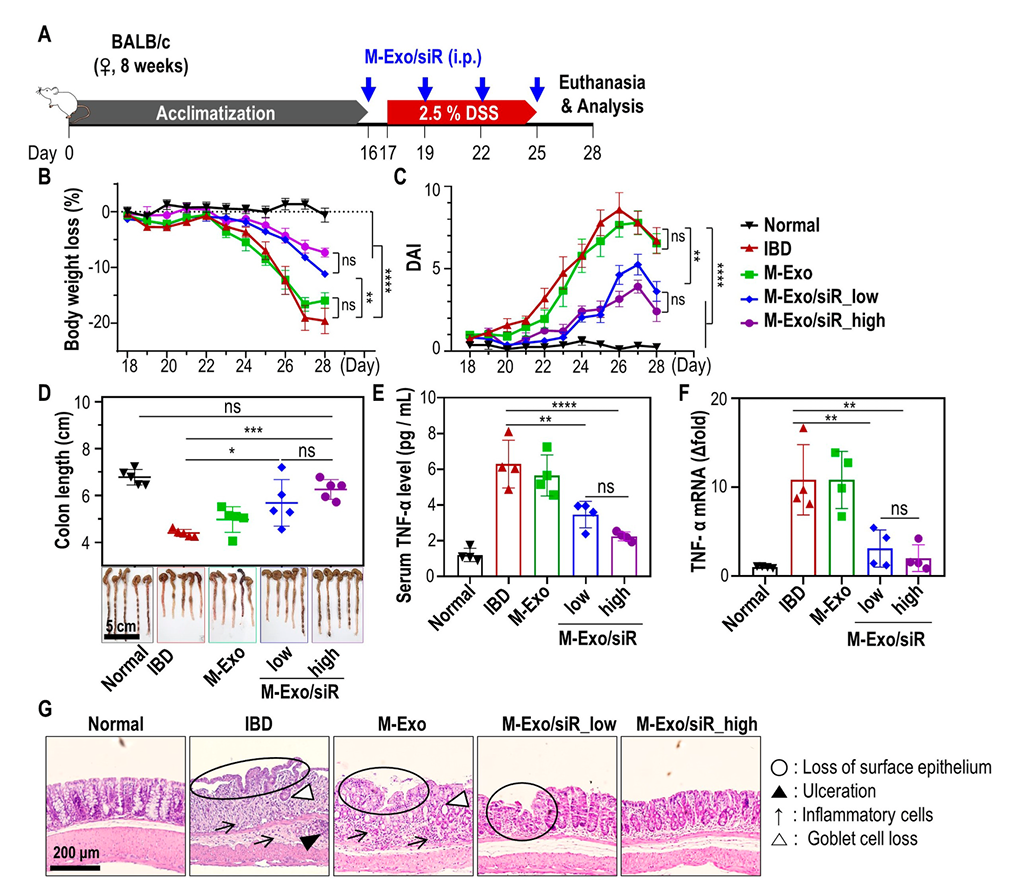
2.3 动物实验证明,siRNA的成功转运可下调TNF-α水平从而改善结肠炎症状态
作者为了探究M-Exo/siR对结肠炎的体内治疗效果,使用DSS造模后的小鼠(具有体重减轻、结肠缩短和结肠炎症等临床表现),每隔3天对小鼠进行腹腔药物注射,包括低浓度(16 nmol/kg)、高浓度(32 nmol/kg)的携带siRNA的M-Exo/siR(图3A)。结果显示,低浓度和高浓度M-Exo/siR治疗组,小鼠体重恢复情况及疾病活动指数(DAI)下降水平均优于对照组(图3B和C)。此外,低浓度和高浓度M-Exo/siR处理组的结肠长度显著长于IBD组或M-Exo组(图3D)。与对照组相比,M-Exo/siR组中血清TNF-α和mRNA的表达水平也显著降低(图3E-F)。HE染色显示,IBD组和M-Exo组,小鼠结肠炎性细胞浸润、溃疡形成和腺上皮及杯状细胞减少;而M-Exo/Sir组小鼠结肠仅有轻度的上皮损失(图3G)。
2.4 口服M-Exos中的TNF-α siRNA可有效到达小鼠肠道
作者评估了MExos在小鼠体内的生物利用度和组织分布,主要包括心脏、肺、脾、肾、肝和胃肠道,结果清楚地显示了M-Exos在胃肠道内的强荧光信号(图4A)。口服给药8小时内,胃肠道逐渐吸收M-Exos,随后信号减弱。在H-Exos的小鼠胃肠道中显示了微弱的荧光信号。为了进一步证实siRNA被M-Exos递送到肠中,作者用Cy3标记负载siRNA的外泌体,图4B结果显示,在M-Exo/siR小鼠的胃、小肠和大肠中均有强siRNA信号。作者基于M-Exos和H-Exos的物理化学性质,从脂质组学角度进一步评估了siRNA递送的差异,发现M-Exos独特的脂质组成是保持其胃肠道稳定性的基础(图4C和D)。

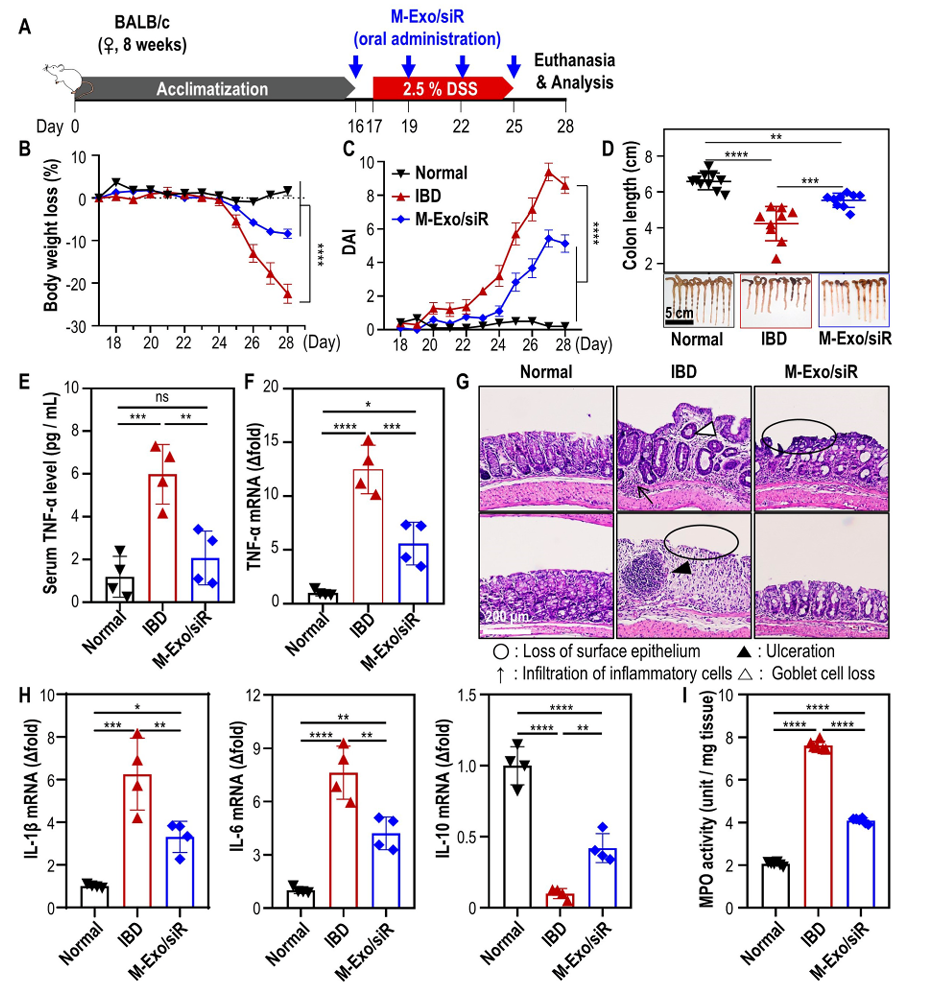
2.5 口服M-Exo/siR可逆转结肠炎引起的炎症细胞因子失衡
作者进一步评估了口服M-Exo/siR对肠屏障功能受损的结肠上皮的影响。实验证明,口服M-Exo/siR有效地改善了结肠相关的炎症,小鼠体重恢复、DAI评分改善和结肠长度恢复(图5B-D)。此外,与DSS结肠炎小鼠相比,M-Exo/Sir治疗小鼠的血清TNF-α表达显著降低。HE染色显示,与IBD组相比,M-Exo/siR治疗组结肠溃疡明显减少,M-Exo/siR治疗可保护结肠上皮免受损伤。(图5G)TNF-α相关的基因表达分析表明,M-Exo/siR降低了促炎细胞因子(IL1β和IL 6)的水平,增加了抗炎细胞因子IL10的表达(图5H)。髓过氧化物酶(MPO)活性的测量结果显示,M-Exo/siR治疗减轻了结肠组织的MPO活性(图5I)。总而言之,通过口服M-Exo/siR可有效、安全地改善小鼠的结肠炎症。
该研究将TNF-α siRNA装载到M-Exos中,并在小鼠模型中评估其治疗结肠炎的疗效。结果发现,口服M-Exo/siR可稳定地通过胃肠道到达结肠炎病变,并在小鼠炎症病变部位内降解。最终,TNF-α表达的下调降低了炎症结肠中的促炎细胞因子和ROS水平,减轻了结肠炎。这种基于M-Exo的口服给药方式可能是IBD的有效生物治疗模式。
参考文献:Han G, Kim H, Jang H, Kim ES, Kim SH, Yang Y. Oral TNF-α siRNA delivery via milk-derived exosomes for effective treatment of inflammatory bowel disease.Bioact Mater. 2023;34:138-149. Published 2023 Dec 22. doi:10.1016/j.bioactmat.2023.12.010



